加快您获得结果的时间至关重要。为了尽可能节省您的时间,CST 严格测试并开发产品专属实验步骤,包括已针对 IHC 进行验证的各种抗体的最佳使用条件。通过检测多种抗原修复和免疫染色方法,以及开发配套试剂来增强抗原检测和改善 IHC 实验步骤效率,从而提前解决这些问题。
如果您确实需要执行一些疑难排除,欠佳的 IHC 染色常通常可以通过调整相对较少的变量得到解决。调整实验步骤内的关键步骤(如抗原修复)通常可解决这些常见问题。
免疫组织化学实验技巧和技术
免疫组织化学实验步骤
您的免疫组织化学 (IHC) 试验完全没有染色可能提示抗体或实验步骤有问题。确保您的抗体对于推荐应用已过验证,并使用高表达阳性对照(如石蜡包埋的细胞沉淀物),以此确保抗体和流程按预计发挥作用。
磷酸化特异性抗体(尤其)或任何针对很少表达的蛋白的抗体可能不会出现染色,这在给定指示的案例中占到100%。样品也可能是真阴性。
存放一段时间后,IHC 玻片可能会丢失信号。存储过程可能有所不同,具体取决于蛋白质靶标。对于每种蛋白,玻片储存对染色的影响尚不明确,因此最好的做法是在使用前新鲜制备玻片。如果玻片必须存放,请在 4°C 中进行保存;我们不建议在存放前烘烤玻片。在整个染色过程中,组织切片保持用液体覆盖非常重要。
脱蜡不充分可能会导致有污渍,甚至在您的 IHC 试验中导致背景染色。如发生该情况,我们建议利用新鲜的二甲苯制备新组织切片以重复实验。
固定的组织切片在蛋白间有化学交联,具体根据组织和抗原靶标有所不同,这些交联可能会妨碍抗体进入或遮蔽抗原靶标。抗原修复实验步骤中可使用热水浴、微波炉或高压锅。不建议使用水浴槽的抗原修复实验步骤。最好使用微波炉进行抗原修复,但特殊组织或抗原靶标的染色可能需要使用高压锅。
特殊组织或抗原靶标的染色可能需要优化的修复缓冲液。CST 在每份产品数据表上均提供了推荐抗原暴露缓冲液的优化实验步骤。我们建议始终每天配制新鲜的 1X 溶液。
要查找我们所有经 IHC 验证的抗体的产品专属实验步骤,请从这里开始。
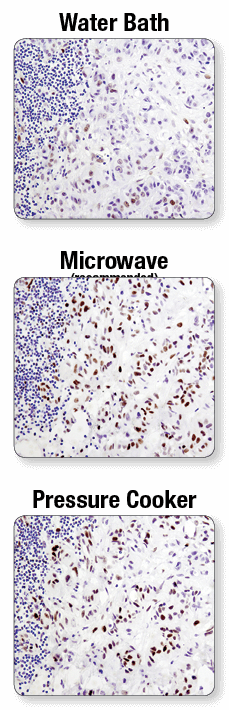
抗原修复建议使用微波炉。 在利用水浴锅(上图)、微波炉(中图)或高压锅(下图)对抗原进行修复后,利用 Phospho-Stat3 (Tyr705) (D3A7) XP® Rabbit mAb #9145 对石蜡包埋人肺癌进行 IHC 分析。实验中,可见使用微波炉和水浴锅修复结果的显著不同。对于一些抗体而言,使用高压锅得到的信号比使用微波炉得到的信号强度大。
CST 为各 IHC 验证抗体产品提供具有建议稀释度的优化方案和 稀释剂。如果使用建议之外的某种试剂,则可能需要对抗体进行滴定。
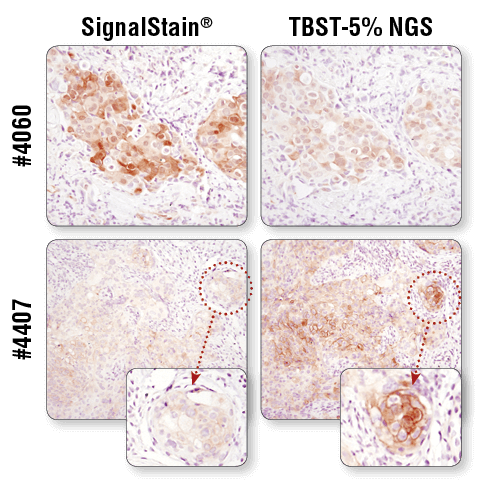
为获得最佳结果,应如产品数据表所述始终使用推荐的一抗稀释剂。 在用 SignalStain® Antibody Diluent (左图)或 TBST/5% NGS(右图)稀释后,利用 Phospho-Akt (Ser473) (D9E) XP® Rabbit mAb #4060 或 Phospho-EGF Receptor (Tyr1173) (53A5) Rabbit mAb #4407 对石蜡包埋人乳腺癌(上图)和 HCC827 异种移植物(下图)进行的 IHC 分析。如图所示,与用 TBST/5% NGS 稀释相比,#4060 经 SignalStain®Antibody Diluent 稀释所得信号强度更强 。相比之下,#4407 在用 TBST/5% NGS 稀释时的效果更好。请查阅产品数据表中针对所选特异性抗体的推荐稀释剂。
按照经严格检测的实验步骤进行一抗孵育,才能获得一致、可靠的结果。经开发和验证的 CST 抗体在 4°C 下过夜孵育时可获得最佳结果。
SignalStain® Boost IHC Detection Reagents (#8114) 和 (#8125) 以及 SignalStain® DAB Substrate Kit (#8059) 等基于聚合物检测试剂比亲和素/生物素检测系统更敏感。直接偶联 HRP 的标准二抗可能不具有充分的信号放大功能。使用前务必核实检测试剂的失效日期。
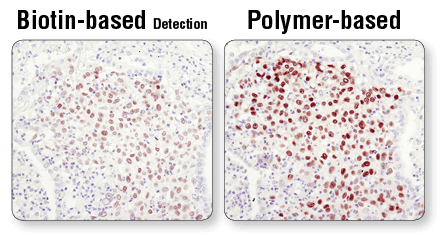
基于聚合物的检测比基于生物素系统更敏感。 利用 Sox2 (D6D9) XP® Rabbit mAb #3579 和采用基于生物素的检测(左图)或基于聚合物的检测(SignalStain® Boost IHC Detection Reagent #8114;右图)对石蜡包埋的人肺癌进行的 IHC 分析。如图所示,基于聚合物的检测敏感度更高,染色强度更好。
脱蜡不充分可能会导致有污渍,甚至在 IHC 实验中导致背景染色。如发生该情况,需利用新鲜的二甲苯制备新组织切片以重复实验。。
如果使用 HRP 检测系统,样品中的内源性过氧化物酶活性可能会产生过强的背景信号。在这种情况下,在用 RODI 水稀释的3% H2O2 溶液中对玻片淬火10 分钟,随后用一抗孵育。
对于具有高水平内源性生物素的样品(如肾脏和肝脏组织),使用基于生物素的检测系统可能会出现问题。在这种情况下,使用基于聚合物的检测系统,如 SignalStain® Boost IHC Detection Reagents (#8114 和 #8125)。在正常封闭步骤之后,还可进行生物素封闭,随后再用一抗孵育。
为确保您 IHC 实验中的封闭充分,在与一抗孵育前使用含 5% Normal Goat Serum (#5425) 的1X TBST (#9997) 30 分钟。
稀释比例和稀释剂的产品专属建议可在所有 IHC 验证抗体的数据表和产品页面上获得。切记如果使用建议之外的某种试剂,则可能需要对抗体进行滴定。
对于二抗来源物种与检测样品来源物种相同的某些样品,二抗可能会结合内源性 IgG,导致背景较高(例如,鼠对鼠染色)。应始终准备一个未经一抗染色的对照玻片,以确定二抗是否是背景的来源。
若要查找关注靶标的对照切片,请从 这里开始。
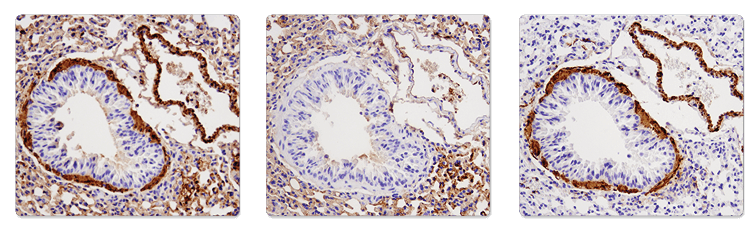
使用α-Smooth Muscle Actin (1A4) Mouse mAb (IHC Formulated) #56856(左图)、仅SignalStain® Boost IHC Detection Reagent (HRP, Mouse) #8125 (中图)或 α-Smooth Muscle Actin (D4K9N) XP® Rabbit mAb #19245(右图)对石蜡包埋小鼠肺进行的免疫组织化学分析。注意由于对小鼠组织使用使用抗小鼠抗体导致出现的鼠对鼠背景(左图和中图)。使用抗兔二抗试剂(SignalStain® Boost IHC Detection Reagent (HRP, Rabbit) #8114)消除了 MOM 背景(右图)。
充分洗涤对于比较低背景和强信号非常关键。建议在用一抗和二抗孵育后,切片用 TBST (9997#) 洗涤 3 次,每次 5 分钟。
对照玻片是可用于评估染色试剂和 IHC 方法性能的一个宝贵工具。每张玻片都含有阴性和阳性的福尔马林固定石蜡包埋 (FFPE) 细胞沉淀物。