一次成功的 ChIP-seq 实验需要一种能在全基因组所有序列环境下检测出正确靶蛋白的抗体。抗体在 ChIP-qPCR 中的良好性能不一定就意味着抗体用于 ChIP-seq 的性能也好,因为 ChIP-seq 需要在大量基因位点捕获到更多靶蛋白。为提供经 ChIP-seq 验证有效的抗体,CST 使用 SimpleChIP® 酶解和 SimpleChIP® 超声处理染色质免疫沉淀实验步骤,随后使用下一代测序分析 (NGS) 来对重组兔单克隆抗体进行 ChIP-seq 验证。
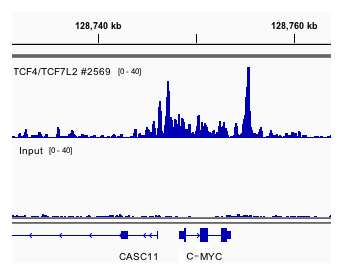
使用 SimpleChIP® 酶解染色质免疫共沉淀试剂盒(磁珠法) #9005 对 HCT116 细胞的交联染色质和 TCF4/TCF7L2 (C48H11) 兔单克隆抗体 #2569 进行染色质免疫沉淀。使用 DNA Library Prep Kit for Illumina (ChIP-seq, CUT&RUN) #56795 制备 DNA 文库。与输入对照(下通道)相比,结果图显示在 TCF4/TCF7L2 的已知靶基因 c-MYC 内特异性结合 TCF4/TCF7L2(上通道)。c-MYC 基因的平均信噪比是 21.58。
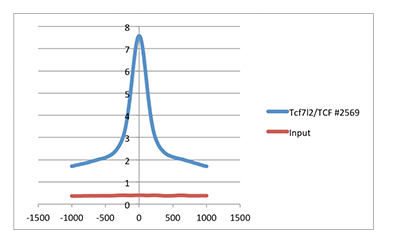
使用 SimpleChIP® 酶解染色质免疫共沉淀试剂盒(磁珠法) #9005 对 HCT116 细胞的交联染色质和 TCF4/TCF7L2 (C48H11) 兔单克隆抗体 #2569 进行染色质免疫沉淀。使用 DNA Library Prep Kit for Illumina (ChIP-seq, CUT&RUN) #56795 制备 DNA 文库。如结果图中所示,比较 TCF4/TCF7L2 富集度(蓝线)与输入对照(红线)时,本实验中全基因组内的平均信噪比为 4.44。
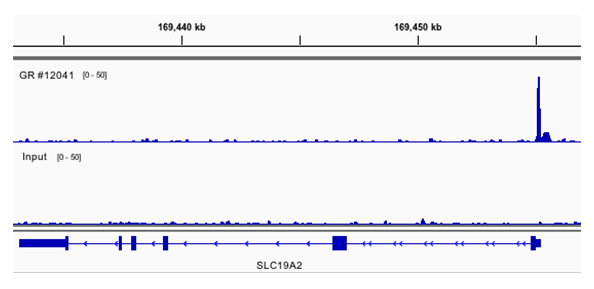
使用 SimpleChIP® 酶解染色质免疫共沉淀试剂盒(磁珠法) #9005 对在含有 5% 活性炭剥离 FBS 的培养基中培养 3 天,随后用 100 nM dexamethasone 处理 1 小时的 A549 细胞的交联染色质与 Glucocorticoid Receptor (D6H2L) XP® 兔单克隆抗体 #12041 进行染色质免疫沉淀。使用 DNA Library Prep Kit for Illumina (ChIP-seq, CUT&RUN) #56795 制备 DNA 文库。与输入对照(下通道)相比,结果图显示在 GR的已知靶基因 SLC19A2 内特异性结合 GR(上通道)。41% 富集 GR 抗体的 DNA 片段含有已知的糖皮质激素反应元件结合基序 GNACANNNTGTNC。
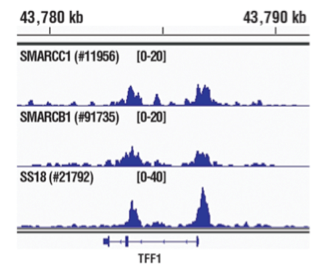
使用 SimpleChIP® 酶解染色质免疫共沉淀试剂盒(磁珠法) #9005 对在无酚红的培养基和 5% 活性炭剥离的 FBS 中生长 4 天,随后用 β-雌二醇(10 nM,45 分钟)处理的 MCF7 细胞的交联染色质与 SMARCC1/BAF155 (D7F8S) 兔单克隆抗体 #11956、SMARCB1/BAF47 (D8M1X) 兔单克隆抗体 #91735 或 SS18 (D6I4Z) 兔单克隆抗体 #21792 进行染色质免疫沉淀。使用 DNA Library Prep Kit for Illumina (ChIP-seq, CUT&RUN) #56795 制备 DNA 文库。SMARCC1/BAF155、SMARCB1/BAF47 和 SS18 均为 SWI/SNF 复合体的所有亚基。正如预计的一样,SWI/SNF 复合体的所有三个蛋白亚基都显示在 SWI/SNF 复合体的已知靶基因 pS2/TFF1 内重叠结合。