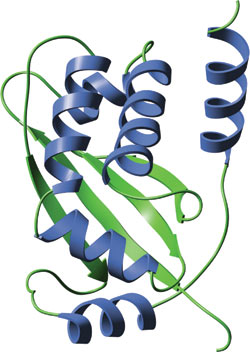
人 TRAF 2 的单体 TRAF 结构域。
约有 150 个氨基酸的 TRAF 结构域可见于肿瘤坏死因子 (TNF) 受体相关因子。TRAF 蛋白似乎是一种相对最新进化的发育蛋白,因为只有一种秀丽隐杆线虫 TRAF 蛋白、两种果蝇和六种哺乳动物 TRAF 蛋白。除了在胞核中发现的 TRAF4 之外,所有哺乳动物 TRAF 位于细胞浆。通过其 TRAF 结构域与激活 TNF 受体、IL-1/Toll 受体之间的相互作用或通过 TRADD 等中间蛋白,TRAF 蛋白聚集到膜。通过激活 NF- κB 和 AP-1 转录因子,TRAF 在与 TNF 受体相互作用时在细胞存活中发挥主要作用。六种哺乳动物 TRAF 蛋白有不同功能。例如,TRAF3 调节依赖于 T 细胞的抗原反应,TRAF4 则是形成气管所必需的,TRAF6 则调节 IL-1、CD40 和 LPS 信号转导。TRAF 还结合 LMP1 并后续增强生长和转化,从而在 Epstein-Barr 病毒复制中起到重要作用。
TRAF 结构域包含一个高度保守的卷曲螺旋结构域、以及一个 TRAF-羧基末端结构域。氨基末端卷曲螺旋结构域含有一个 α 螺旋,而 TRAF-羧基末端结构域则折叠成为一个 β 夹心结构。TRAF 结构域低聚化成为二聚体、三聚体和/或异三聚体。TRAF-2 的 TRAF 结构域的三聚结构是一个卷曲螺旋区域,会与 TRAF- 羧基末端结构域形成一个柄状结构,其中羧基末端结构域会在这个柄状结构下形成三个单独的叶状结构。
| TRAF 结构域蛋白 | 结合伴侣 |
| TRAF 1,2,3,5 | CD40 |
| TRAF 1,2 | TRADD |
| TRAF6 | IRAK |
| TRAF 2 | TNFR1 |
| TRAF 6 | IL-1 |