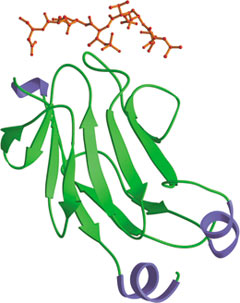
Rad 53p 结合磷酸化苏氨酸肽的氨基末端 FHA 结构域(红色)。
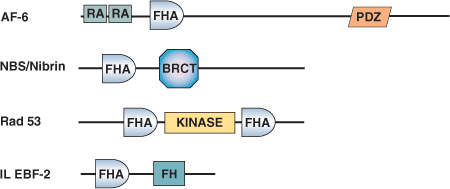
叉头相关蛋白 (FHA) 结构域最初被发现是叉头转录因子的一个保守区域。FHA结构域长约 65-100 个氨基酸,并形成包含3 条反向平行链和 4 条反向平行链的β片层组成的β 夹心折叠结构。虽然该结构域的氨基和羧基末端位于邻近的 β 链,但对侧则由环结合在一起,环可协调磷酸肽结合。FHA 结构域主要见于在 DNA 损伤反应中发挥作用的真核细胞胞核蛋白,但也见于包括支原体细菌(如结核分枝杆菌)在内的某些原核细胞。FHA 结构域会介导磷酸肽与被丝氨酸/苏氨酸激酶磷酸化的蛋白之间的相互作用。多数 FHA 结构域可用于检测磷酸化苏氨酸,其中特异性由羧基末端残基提供给磷酸化苏氨酸残基,尤其是 +3 位点。Rad53 和 PNK 的 FHA 结构域结合 pTXXD 磷酸肽。
| FHA 结构域蛋白 | 结合伴侣 |
| KAPP Ser/Thr Phosphatase Kinase | pRLK5(磷酸化)拟南芥受体样丝氨酸/苏氨酸激酶 |
| Rad53 S. cerevisiae Ser/Thr Kinase | pRad9(磷酸化)酿酒酵母检查点控制蛋白 |
| MDC1 | ATM, CHK2 Ser/Thr kinases |
| Ki67 | hNIFK |
| 多聚核苷酸激酶 (PNK) | XRCC1 and XRCC4 |