染色质免疫沉淀 (ChIP) 测定法是一项强大的通用技术,用于在细胞天然染色质环境下检测蛋白-DNA 相互作用。这种测定法可用于检测与基因组某个特定区域有关的多种蛋白,或相反,用于检测与某种特殊蛋白有关的基因组的多个区域。此外,ChIP 实验可用于明确某种特殊蛋白-DNA 相互作用的空间和时间关系。例如,ChIP 实验可用于确定各种蛋白因子被募集到某个基因启动子上的特定顺序,或用于“测量”基因激活期间整个基因位点上某种特殊组蛋白修饰的相对数量。除了组蛋白,ChIP 实验还可用于分析转录因子、转录辅因子、DNA 复制因子和 DNA 修复蛋白的结合。
可以。SimpleChIP® Plus Sonication Chromatin IP Kit #56383、SimpleChIP® Plus Enzymatic Chromatin IP Kits #9004 和 #9005 的开发目的是为了检测培养的细胞和组织样品,含有有关对细胞和组织样品进行交联、染色质制备和免疫沉淀的详细实验步骤。此外,SimpleChIP® Plus 实验步骤随时可扩展,让用户能够根据所进行的免疫沉淀次数,在每个实验步骤快速测定要使用的试剂数量。
SimpleChIP® Plus Sonication Chromatin IP Kit #56383、SimpleChIP® Enzymatic Chromatin IP Kit (Magnetic Beads) #9003 和 SimpleChIP® Plus Enzymatic Chromatin IP Kit (Magnetic Beads) #9005 均可用于 ChIP-Seq 实验。这些试剂盒包含 Protein G Magnetic beads,无需 DNA 封闭试剂。这对 ChIP-Seq 非常关键,因为任何封闭的 DNA残留 均会污染下游测序读取。
除了优化超声处理条件外,改变交联时间还会显著影响超声处理染色质碎裂。在对组织样品进行 ChIP 时,将交联时间从 10 分钟延长至 30 分钟会增加染色质结合的转录因子和辅因子的富集。更长的交联时间可能会增加染色质片段的大小,因此通常有必要在染色质声处理期间保留交联的转录因子和辅因子。参见实验步骤和下文的“染色质在琼脂糖凝胶上是什么样的?”,了解有关理想片段大小范围的详细信息。
在优化声处理的染色质碎裂的条件时,应考虑剪力、超声处理时间和超声处理缓冲液。SimpleChIP® Plus Sonication Chromatin IP Kit #56383 含有特殊配制的细胞和胞核裂解缓冲液,可提供对转录因子和辅因子进行免疫沉淀所需的最佳温和超声处理条件。这些缓冲液还非常适合用于对组蛋白和组蛋白修饰进行免疫沉淀。
为了使用你的目的抗体进行 ChIP 实验的染色质免疫沉淀部分,需要将交联的染色质碎裂成更小的片段,片段长约 150-900 个碱基对 (bp),并且必须从胞核中释放出来。可使用超声处理或酶解来产生合适长度的染色质。
作为染色质碎裂的一种更传统的方法,超声处理使用声能来强力剪切染色质。超声处理的染色质非常适合用于进行 ChIP,以评估组蛋白和组蛋白修饰,这些是染色质的富集和稳定组分。但过度超声处理会损坏染色质,并取代结合的转录因子和辅因子,因此,超声处理通常需要优化。CST 开发和优化了我们 SimpleChIP® Plus Sonication Chromatin IP Kit #56383 中的细胞和胞核裂解缓冲液,可防止染色质中转录因子和辅因子的降解和解离,从而显著改善 ChIP 信号。参见性能比较数据
酶消化使用微球菌核酸酶来切割核小体之间的连接区域。它可以温和地碎裂染色质,保留染色质和结合蛋白的完整性。因此,它更适合用于进行 ChIP 来评估转录因子和辅因子,这些因子不太富集,并且与 DNA 的相互作用不太稳定。此外,与超声处理相比,酶消化在实验之间具有更高的可重复性。但过度消化可能会导致不含核小体的区域丢失。
在通过消化碎裂染色质时,测量用来制备染色质的细胞数或组织数量非常重要。我们建议每次计划的免疫沉淀反应收集 4x106 个细胞或 25 mg 组织。在对染色质进行酶消化之前,交联组织样品并分离为单细胞悬浮液。对于染色质消化,所添加的细胞数/微球菌核酸酶 体积比对于将染色质碎裂成为合适大小(150-1000 个碱基对)非常关键。虽然这个比例根据不同细胞或组织类型稍有不同,但我们发现 4x106 个细胞(或 25 mg 组织)/0.5 µl 微球菌核酸酶的比例可重复性地将染色质消化成为大小合适的片段。每个 SimpleChIP® 试剂盒均含有疑难排解指南,以便优化使用细胞或组织进行的染色质消化。
用缓冲液 A 和 B 孵育并不能完全裂解甲醛交联细胞和胞核膜。相反,它仅能渗透细胞,让微球菌核酸酶进入并消化染色质。需要进行稍微超声处理,才能将染色质释放到溶液中。超声处理不会进一步碎裂染色质。
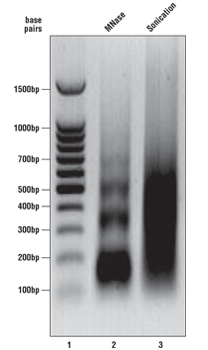
正如在 SimpleChIP® 试剂盒实验步骤中所述的,在消化后和进行免疫沉淀之前,分析一份染色质样品。请参阅右侧的琼脂糖凝胶,了解染有溴化乙锭的 1% 琼脂糖凝胶上的理想染色质外观。DNA 标记物在泳道 1,微球菌酶消化的染色质 DNA 在泳道 2,超声处理碎裂的染色质 DNA 在泳道 3。经微球菌酶消化的染色质 DNA 应剪切为含有 1、2、3、4 和 5 个核小体的片段(长约 150-1000 个碱基对,泳道 2),而经超声处理的染色质 DNA 应产生拖尾(100-1000 个碱基对,泳道 3)。我们根据 OD260 来测定染色质 DNA 浓度,不同细胞和组织类型通常观察到浓度为 125–250 µg/ml。如果您的染色质看起来不像本结果图中所示的染色质,请参考每个实验步骤的附录,以优化染色质消化。
注:对于超声处理染色质碎裂,使用最低超声处理周期数,可产生所需的大小范围 (200-1000bp)。如果使用更长的交联时间,则预计的片段大小范围将更高(30-60% 的片段 < 1kb)。在这种情况下,进一步的超声处理可能会导致非组蛋白与 DNA 解离,使用转录因子或辅因子抗体进行 ChIP 实验时应避免。
注:对于酶解染色质碎裂,如果您仅观察到约 150 bp(单个核小体)的条带,则染色质被过度消化。对于所使用的细胞数或组织数量,您添加了太多的核酸酶。消化中添加更少的核酸酶或增加细胞数或组织数量(参见实验步骤中的附录来进行优化)。
对于所有蛋白靶标,我们每次免疫沉淀 (IP) 开始使用 4x106 个细胞或 25 mg 组织样品。在每次免疫沉淀中,这通常可产生 10-20 µg 染色质。但对于组蛋白免疫沉淀,仅 1x106 个等量细胞或 2.5–5 µg 染色质就足够了。经超声处理的染色质必须按照 1:4 或更高的比率用 1X ChIP 缓冲液稀释,一般会产生 500 µL 或更多的反应体积。如果体积高于 500 µL,则不再需要额外的抗体或蛋白 G 微珠,但延长孵育时间是有用的。对于酶解制备的染色质样品,稀释可选,并且可使用任何所需体积的未稀释染色质来进行 免疫沉淀。
如果 CST 对抗体进行了 ChIP 验证,请参考抗体产品数据表,了解一次免疫沉淀要使用的准确抗体量。使用 SimpleChIP® 试剂盒的稀释度在“建议的抗体稀释度” 下提供,而用于验证实验的确切抗体体积和染色质数量在抗体产品数据表的“染色质免疫沉淀”结果图中提供。在 CST 验证抗体时,我们始终通过滴定抗体来测定酶解和声处理实验步骤的最佳稀释度,实验步骤中,每次免疫沉淀使用 4x106 细胞(10–20 µg 染色质)。
如果CST 未对抗体进行 ChIP 验证,则我们不能保证抗体在 ChIP 实验中的性能。如果您关注的靶标没有经 ChIP 验证的抗体,但您想要在 ChIP 实验中尝试我们的一种其他抗体,那么我们建议选择一种经正常免疫沉淀验证的抗体,每次染色质免疫沉淀反应使用 0.5–5 µg 抗体。如果客户使用我们未经ChIP 验证的 CST 抗体取得了成功,我们欢迎客户提供反馈(立即联系我们或给我们发送电子邮件,地址为 [电子邮件受保护])。
在 SimpleChIP® 试剂盒中,两种微珠性能相同。我们完成了平行比较,结果表明使用两种微珠时,最弱背景信号和特异性结合相同。琼脂糖微珠是用于免疫沉淀的传统微珠。磁珠相对更昂贵,但更容易使用。在吸干上清液时,微珠黏附在试管侧,不会在吸干洗涤缓冲液以及更彻底的洗涤期间导致材料丢失,因为可以吸干珠子上的所有上清液。它们都不需要离心分离,但需要磁分离架(#7017 或 #14654)。
磁珠可用于进行 ChIP 测序实验,因为不会封阻 DNA。琼脂糖微珠会封阻经超声处理的鲑鱼精 DNA,从而减弱背景信号。在进行高通量测序期间,携带任何封阻的 DNA 都会妨碍序列读取。
在 CST,我们使用定量实时 PCR 和 4.5 倍的稀释梯度来验证抗体,首先从 2% 的总输入染色质开始。对于每份输入染色质 qPCR 样品,我们使用这个稀释梯度(2%、0.4%、0.08%、0.016%)来根据 CT 值生成标准曲线。这让我们将在每次 qPCR 反应中所测的 CT 值转换为总输入染色质的百分比,从而计算每份免疫沉淀样品中的 DNA 富集度。
如果您使用试剂盒中提供的对照 Histone H3 (D2B12) XP® Rabbit mAb (ChIP Formulated) #4620 和对照 SimpleChIP® RPL30 引物,那么您应该观察到 RPL30 启动子的富集度为 2- 4% 的总输入染色质。使用 Normal Rabbit IgG #2729 所获得的背景富集度应低于 0.1% 总输入染色质。
我们将“阳性”ChIP 结果定义为:特定基因组位点(即转录因子结合其靶标启动子)的抗体富集度至少比相同抗体在非特异性位点(即相同转录因子结合非靶标启动子)的富集度大 4 倍,并且至少比 Normal Rabbit IgG #2729 在特定位点的富集度大 5 - 10倍。阳性 ChIP 富集度的范围可低至 0.5% 总输入染色质(即转录因子和辅因子),可高达 40-50% 总输入染色质(即乙酰化和甲基化组蛋白)。使用 Normal Rabbit IgG #2729 时,我们使用磁珠和琼脂糖微珠产生的背景水平通常为 0.05-0.1% 的总输入染色质。
PCR 结果根据所使用的 PCR 引物组和抗体有所不同。应使用合适的阳性和阴性对照来设计实验,以确保 PCR 反应能正常扩增,所获得的所有信号都是实时的。
在 ChIP-seq 中,输入样品可用作阴性对照,以标准化库构建和 NGS 测序所致的偏差。对于 IgG 所致的沉淀 DNA,输入样品有优势,因为它不怎么费力,并能提供创建一个更复杂测序库所需的足够 DNA。
在使用输入测序数据进行标准化之后,应找出转录因子和辅因子的可接受的高峰次数。在覆盖多个完整基因区域的基因组中,某些组蛋白修饰及其辅因子的高峰非常宽。在这种情况下,所检测到的宽峰数量不可靠,因为确定宽峰的可用程序有限。所有的窄峰和宽峰必须在全基因组内显示出可接受的信噪比。对于转录因子抗体,进行基序分析来确定某个已知的结合基序是否在 ChIP-DNA 中富集。
SimpleChIP® Control PCR Primers 可为您的 ChIP 实验和 ChIP 抗体提供完美的阳性和阴性对照。如果您使用试剂盒中包含的阳性对照 Histone H3 (D2B12) XP® Rabbit mAb (ChIP Formulated) #4620 和阳性对照 SimpleChIP® RPL30 引物,您应该可以观察到 RPL30 启动子的富集度为 2- 4% 的总输入染色质。使用阴性对照 Normal Rabbit IgG #2729 时,RPL30 启动子的背景富集度应低于 0.1% 的总输入染色质。此外,组蛋白 H3 是细胞染色质的核心组分,能够结合基因组中的多数 DNA 序列,Histone H3 (D2B12) XP® Rabbit mAb (ChIP Formulated) #4620 可用作几乎所有研究的 DNA 位点的阳性对照抗体。
我们出售阳性和阴性对照引物组,适合我们所有经 ChIP 验证的抗体。我们用这些引物组来在 ChIP 中验证抗体。阳性对照引物组可扩增经证实含有特定组蛋白修饰的基因位点,或结合特定转录因子,而阴性对照引物组则会扩增不含特定修饰或结合因子的区域。请注意,在指定基因位点发现的组蛋白修饰和转录因子根据细胞环境有所不同,因此某些对照引物组可能对指定细胞类型和/或处理具有特异性,具体取决于所研究的组蛋白修饰或转录因子。但其他对照引物组更为通用,可在多种细胞类型中用作许多抗体的对照。例如,RPL30 和 GAPDH 是在多数细胞类型中有活性的管家基因。因此,RPL30 和 GAPDH 对照引物组可用作与多数细胞类型中转录激活有关的组蛋白修饰的阳性对照。同样,α Satellite Repeat Control Primers #4486 能扩增组成型异染色质的区域,可用作与任意细胞类型中转录激活有关的组蛋白修饰和转录因子的阴性对照。
可以。SimpleChIP® Chromatin IP Kits 中的某些个别组分可单独购买(如下所列),以用于额外的染色质制备、免疫沉淀反应、DNA 纯化和 PCR 扩增。
如果您需要不单独出售的特定试剂盒组分,请联系我们,我们也许能够满足您的需要,为您提供定制订单或备选来源。
如有任何其他问题,请直接联系我们的 ChIP 小组,联系方式为 [电子邮件受保护]。
Christopher Fry - 博士
表观遗传学部副主任
Fang Chen, PhD
染色质免疫沉淀开发科学家
发布时间 2010 年 10 月
修订时间 2017 年 7 月