尽管二元方法是评估抗体特异性的更理想的方法之一,但是二元模型并非总是便于取得,并且仅出于验证抗体的目的而生产,可能费时且昂贵。而且,为了评估抗体在应用和实验中的敏感性,需要互补的标志。
适于此目的,范围策略包括使用有高、中和低表达水平表达目的靶标的内源性和异源性模型。范围策略对了解抗体的最佳工作条件至关重要。然而,它对整体抗体验证过程的重要性常常被忽略。
范围策略和二元策略之间最重要(但细微)的区别是,范围模型依赖于靶标表达或修饰非黑即白的差异。通常,范围模型更能反映实际生物学,其中靶标的表达在一个细胞系或组织中相对于另一细胞系或组织而言高或低,或者仅通过激动剂或拮抗剂处理而被稍修饰。这意味着,尽管范围测试结果非常重要,但它们不如二元评估所产生的数据那样引人注目或易于解释。
范围策略标记中还包括了抑制基因/蛋白表达,如不导致完全敲除的 siRNA 等方法。通过将处理后的样品与对照样品进行直接比较,这些技术为抗体验证增加了一定价值,并且通常更易于建立。正如二元测试所描述的那样,应将范围测试与正交策略结合起来以确认表达。
范围模型的一典型案例是使用具有不同水平的蛋白表达或信号的多个样本。然而,尽管可以将实验数据与先前发表的或预测的分析进行关联,但情况并非总是如此,这说明需要使用多种方法评估抗体以建立对特异性和敏感性的信心。
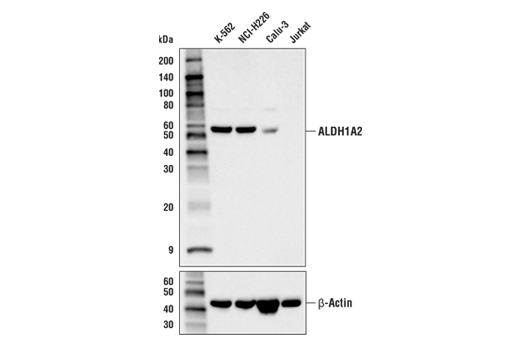
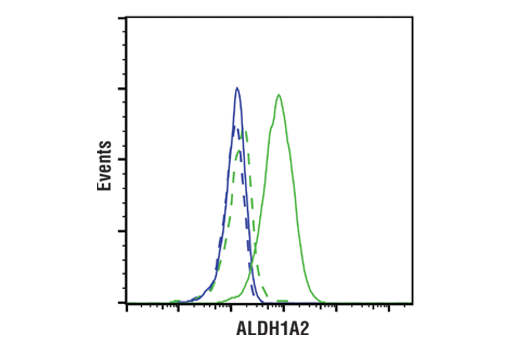
图 1 和图 2 提供了使用多个样本的范围策略的示例。在 图 1,使用 ALDH1A2 (E6O6Q) 兔单克隆抗体来探测不同细胞系的裂解物的蛋白质印迹数据,表明 K-562 细胞中的 ALDH1A2 表达相对于 Jurkat 中表达而言为高表达。图 2 显示使用相同的 ALDH1A2 (E6O6Q) 抗体对 K-562 和 Jurkat 细胞进行流式细胞术分析。如图所示,流式细胞术和蛋白质印迹数据相互支持,上样控制确保样本(分析物)的质量不会导致对结果的曲解。至关重要的是,观察到的 ALDH1A2 表达与可公开获得的生物信息学数据库一致,证明了正交策略(见第 12 页)。
在内源性表达可能不合适的情况下,直接比较处理过的样品和未处理过的样品可用于评估抗体特异性。这揭示了理解靶标的生物学作用以便可以采用适当模型的重要性。
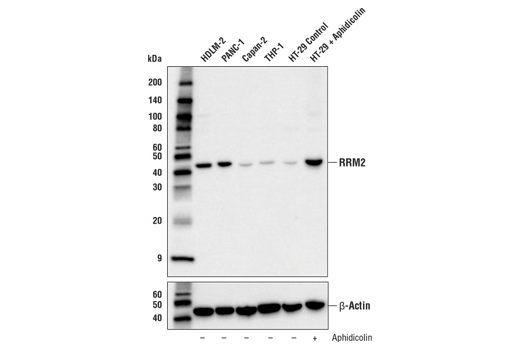
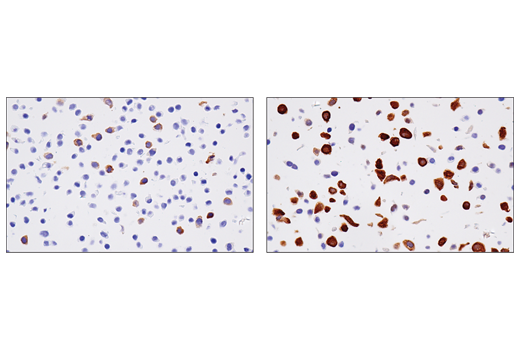
图 3、4、 和 5 显示了使用 RRM2 (E7Y9J) 兔单克隆抗体生成的数据,以检测未经处理的 HT-29 细胞和经阿非迪霉素处理以诱导 RRM2 表达的 HT-29 细胞。通过蛋白质印迹、免疫组化和免疫细胞化学分析可以看出,在阿非迪霉素处理后,RRM2 的表达不是二元的,而是从低到高。在倾向于使用抗体的每种应用中测试模型可确保该应用中抗体的特异性。
尽管在图1-5 中显示的数据清楚地说明了不同样品之间或经过精心选择的处理后靶标表达的差异,但在这些情况下,信号均未完全消除。为了验证特异性并验证实验结果,所以利用多种模型是明智之选。使用这些模型获得的结果应与已发表的生物学或正交数据一致,并且须有其他应用或技术所获得的结果支持。
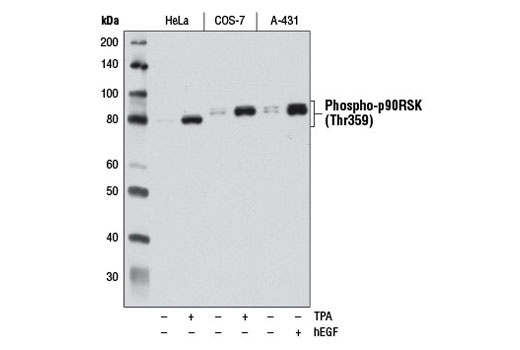
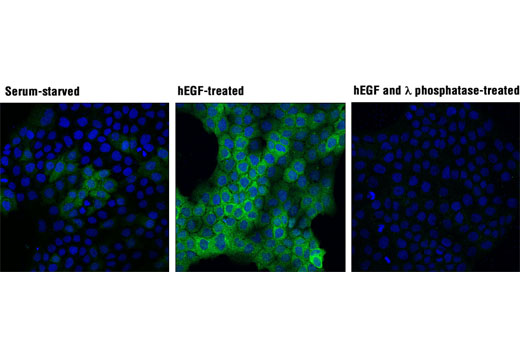
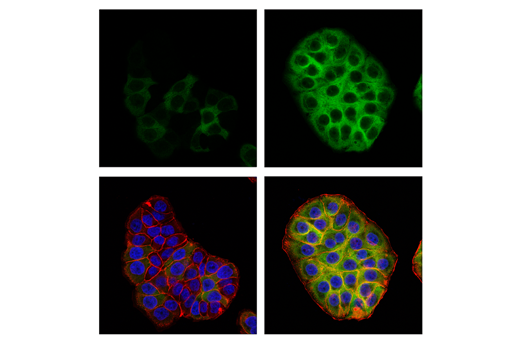
图 6 和图 7 说明了使用多种模型和处理方法,通过与靶标已知生物学机制一致的方法验证 phospho-p90RSK (Thr359) 兔单克隆抗体。图 6 显示了血清饥饿和用 12-O-十四烷酰佛波醇-13-乙酸酯 (TPA) 或人表皮生长因子 (hEGF) 处理后从 HeLa、COS-7 和 A-431 细胞制备的裂解液的蛋白质印迹分析,明确表明在定义的条件下靶标表达增加。在图 7 中,在用 hEGF 处理后,已使用相同的抗体对 A-431 细胞进行免疫细胞化学分析。两种应用都使用同样的模型,独立分析结果相互支持。
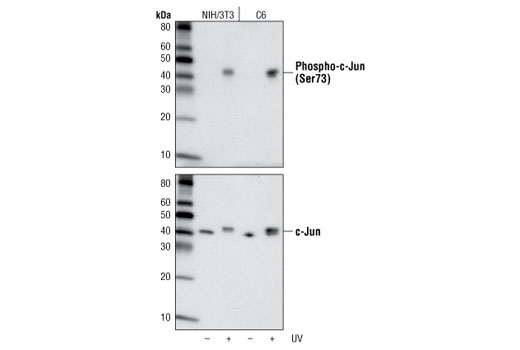
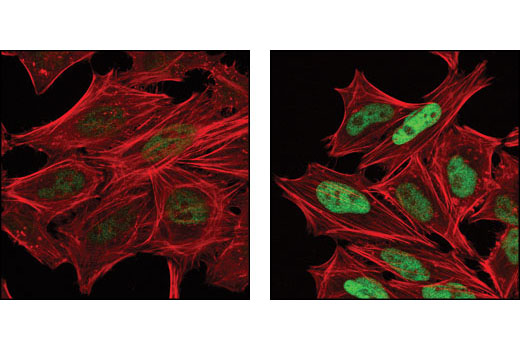
需要注意的是,抗体的敏感性可能根据背景和应用而差异很大。这意味着,在一个应用中可能显示为二元的验证将在另一个应用中采用范围验证,如图 8 和图 9。图 8 显示在暴露于紫外线后,由 NIH/3T3 和 C6 细胞制备的裂解物中 phospho-c-Jun (Ser73) 表达的蛋白质印迹分析。在这些细胞系和本应用中,所得数据显示为二元,仅在处理过的样品中可检测到信号。在 图 9 中,经茴香霉素处理的 HeLa 细胞的免疫细胞化学分析使用相同的抗体。在此,信号在未处理的细胞中非常微弱但能检测到。
务必注意,虽然未经处理的蛋白质印迹通道中不存在磷酸化 c-Jun 信号,但这并不意味着靶标本身不存在。相反,信号可能只是低于蛋白质印迹法的检测阈值。另外,未经处理细胞群的免疫细胞化学分析可检测到弱信号,这可能表明该方法的敏感性更高,或者可能反映出非特异性结合。因为这些原因,应始终使用多种方法支持单次实验中获得的观察结果。