抗体验证的正交策略涉及将基于抗体的结果与基于非抗体方法获得的数据进行交叉对照。这种方法对确认现有抗体验证数据至关重要,并可确定与存疑抗体直接相关的任何影响或伪影响。为了提供更多详细信息以支持本手册中概述的其他策略所产生的结果,正交验证通常利用公共领域中可用的数据。
取决于抗原靶标,基于非抗体的方法可包括挖掘先前发表的结果,通过“组学技术”(基因组学、转录组学和蛋白质组学)以及采用其他已建立的独立于抗体的方法(例如原位杂交或 RNA 测序 [RNA-seq])进行表达分析研究。相应地,也可以使用正交策略来确保内部进行的任何抗体验证均使用最相关的生物学模型作为目的靶标。
在最简单的形式下,正交策略要求通过非基于抗体的检测方法确证获得的其他指标结果。作为一个示例,通过二元或范围策略观察到的靶标的阳性和阴性表达应始终使用正交方法进行确认,例如通过基因测序确认敲除或对 mRNA 进行转录组分析以确认表达。
与本手册中讨论的所有策略一样,依赖单个信息来源或个别结果绝不是个好主意。对于某些目标,有大量可用的表达和生物数据(有时会冲突),以指导验证策略。对于其他目标,可能需要在内部进行适当的实验以支持抗体测试。如果有来自多个可信赖来源的数据,那么这当然可以节省时间和资源。但是,重要的是要注意,有效的正交验证可能需要额外的精力。
尽管已建立的免疫染色技术(例如蛋白质印迹和免疫组织化学)可快速直观地显示抗体特异性,但至关重要的是,正交试验可支持使用这些方法生成的任何抗体验证数据。实现这一目标的一种方法是挖掘公开可用的数据库(例如,CCLE、BioGPS、Human Protein Atlas、DepMap Portal、COSMIC),获得基因组和转录酶分析信息,以帮助了解观察到的免疫染色结果是否相关,还是由于抗体相关的伪影而导致。
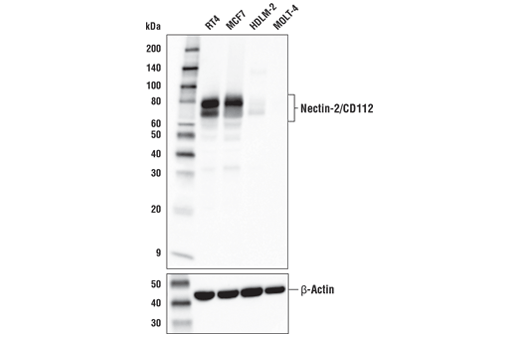
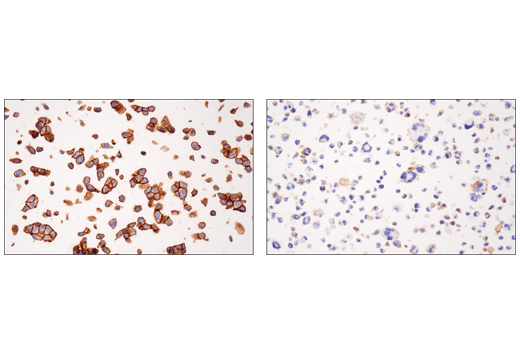
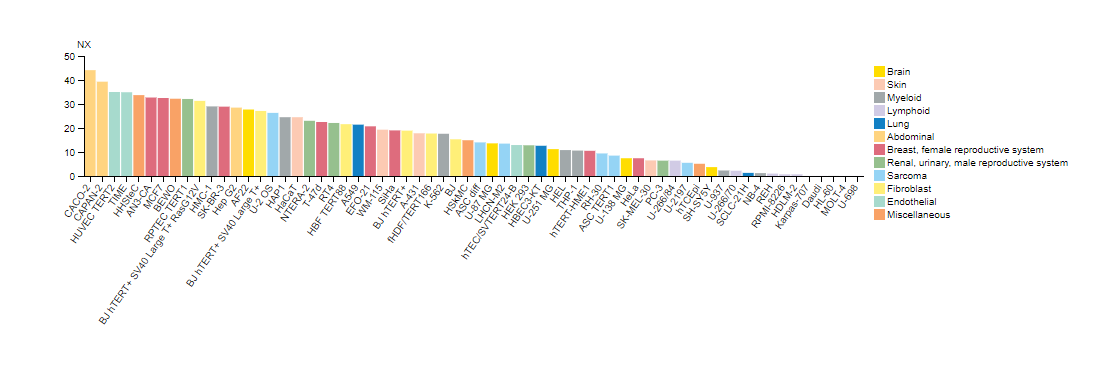
例如,图 1 显示了使用 Nectin-2/CD112 (D8D3F) 兔单克隆抗体在各种细胞系中进行的 Nectin-2 蛋白印迹检测。在 RT4 和 MCF7 中表达明显升高,而在 HDLM-2 和 MOLT-4 中只能看到最低表达。这些结果通过 RT4 和 HDLM-2 细胞沉淀的免疫组织化学分析所反映(图 2),明确表明来自两种不同应用的数据与基于基因组学和转录组学数据预测的 Nectin-2 表达尤其相关,如图 3 所示。
作为各种“组学”技术的补充,原位杂交、RNA-seq 和 RNAscope 等正交方法可以检测组织中的蛋白质表达和/或定位。这些方法尤其适用于验证使用免疫细胞化学或免疫组织化学等成像技术生成的抗体数据。
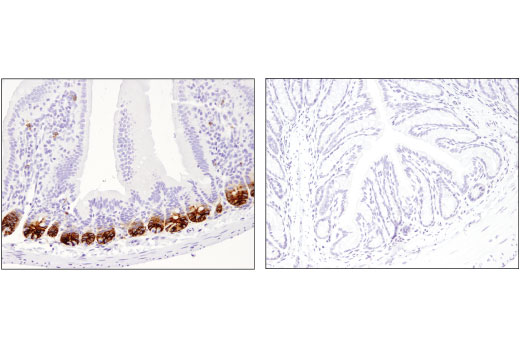
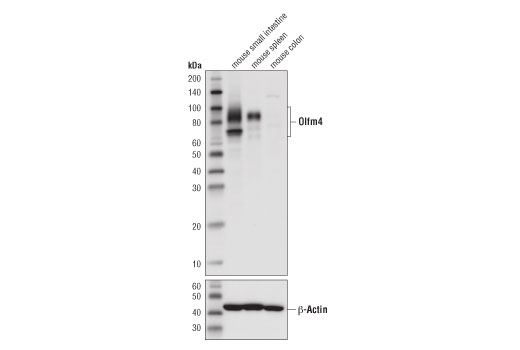
图 4 显示使用 Olfm4 (D6Y5A) 兔单克隆抗体对小鼠 Olfm4 进行免疫组织化学分析。这说明小鼠小肠的阳性染色和结肠的阴性染色,这一发现得到了蛋白质印迹的支持。(图 5)。观察到的染色模式与许多已公开的正交策略一致,包括原位杂交。1,2
正交策略成功的决定性标准是已知或预测的生物学作用与目的基因/蛋白质的定位以及所得抗体染色之间一致。这突出了验证模型和应用(将在下游实验中使用)中所有试剂的特异性和功能性的重要性。
像本手册中描述的其他标记一样,任何一种单独的验证策略无法单独充分验证。尽管正交策略提供了抗体表现出预期的证据,但将正交试验与其他验证方法结合起来以确保对抗体性能的信心至关重要。